Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкенов.
Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
sp2-гибридизация
При образовании σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
Сигма-связь
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
пи-Связь
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120 градусов друг к другу
Методы получения алкенов
Основным промышленным методом получения алкенов является каталитический и высокотемпературный крекинг углеводородов нефти и природного газа. Для производства низших алкенов используют также реакцию дегидратации соответствующих спиртов.
В лабораторной практике обычно применяют метод дегидратации спиртов в присутствии сильных минеральных кислот, дегидрогалогенирование и дегалогенирование соответствующих галогенпроизводных; синтезы Гофмана, Чугаева, Виттига и Коупа.
Подробнее — см. соответствующие разделы ниже.
Дегидрирование алканов
Это один из промышленных способов получения алкенов. Температура: 350—450 °C, катализатор — Cr2O3. Также используются алюмомолибденовые и алюмоплатиновые катализаторы. Для получения транс-алкенов используют MOH/EtOH, для цис-производных NaNH2/NH3
Дегидрогалогенирование и дегалогенирование алканов
Отщепление галогенов у дигалогеналканов происходит в присутствии цинка[16]:
Дегидрогалогенирование проводят при нагревании действием спиртовыми растворами щелочей[17]:
При отщеплении галогенводорода образуется смесь изомеров, преобладающий из которых определяется правилом Зайцева: отщепление протона происходит от менее гидрогенизированного атома углерода.
Дегидратация спиртов
Дегидратацию спиртов ведут при повышенной температуре бани в присутствии сильных минеральных кислот:
В современной практике алкены из вторичных и третичных спиртов также получают с использованием дегидратирующего реагента — реагента Бёрджесса

Гидрирование алкинов
Частичное гидрирование алкинов требует специальных условий и наличие катализатора (например, дезактивированного палладия — катализатора Линдлара):


Реакция Виттига
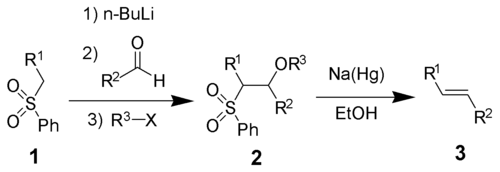
Реакция Виттига — стереоселективный синтез алкенов взаимодействием карбонильных соединений и алкилиденфосфоранов (илидов фосфониевых солей)[19]:
Для превращения солей фосфония в илиды используются бутиллитий, гидрид, амид или алкоголят натрия, а также некоторые другие сильные основания.
В реакцию могут вступать самые различные карбонильные соединения, среди которых ароматические и алифатические альдегиды и кетоны, в том числе содержащие двойные и тройные связи и различные функциональные группы.
В лабораторной практике часто используют более современную модификацию (1959 год) реакции Виттига — реакцию Хорнера-Уодсворта-Эммонса[20]:
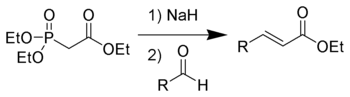
Преимущество использования фосфонатов заключается в том, что образующиеся в ходе реакции фосфаты легко отмываются водой. Кроме того, реакция позволяет избирать оптическое направление элиминирования, получая на выходе транс- (термодинамический контроль) или цис-изомеры (кинетический контроль).
Реакция Кнёвенагеля
Реакция Кнёвенагеля — конденсация альдегидов или кетонов с соединениями, содержащими активную CH2-группу:

Реакция имеет очень широкий диапазон применения, при этом помимо эфиров малоновой кислоты, в реакцию могут вступать и другие соединения, например: CH3CN, CH3NO2, LiCH2COOC2H5 и пр..
Реакция Чугаева
Реакция Чугаева — взаимодействие спиртов с CS2 и NaOH с последующим метилированием и дальнейшим пиролизом образовавшихся S-метилксантогенатов:
Реакция Гофмана
Исчерпывающее метилирование по Гофману — разложение четвертичных аммониевых оснований на алкен, третичный амин и воду:
На первой стадии реакции действием метилиодида амин превращают в четвертичный аммонийиодид, который далее переводят в гидроксид действием оксида серебра, наконец, последний этап — разложение — ведут при 100-200 °C, часто при пониженном давлении[24].
Элиминирование по Гофману приводит к образованию наименее замещенных алкенов (против правила Зайцева).
Метод используется, в основном, для получения некоторых циклических алкенов и в химии алкалоидов.
Реакция Коупа
Реакция Коупа — разложение N-окисей третичных аминов:

Прочие методы синтеза
Реакция Бурда
Реакция Бурда — элиминирование брома и этоксигруппы из бромалкилэтиловых эфиров под действием цинковой пыли:

Синтез из тозилгидразонов
Алкены можно получить разложением тозилгидразонов под действием оснований (Реакция Бэмфорда-Стивенса и Реакция Шапиро):

Реакция Бэмфорда-Стивенса и Реакция Шапиро протекают по одинаковому механизму. В первом случае используются натрий, метилат натрия, гидриды лития или натрия, амид натрия и т. п. Во втором: аллкиллитий и реактивы Гриньяра. В реакция Бэмфорда-Стивенса образуются более замещенные, а в реакция Шапиро — наименее замещенные алкены.
Реакция Перкина
Реакция Перкина — взаимодействие ароматических альдегидов с ангидридами карбоновых кислот в присутствии катализаторов основного характера (щелочных солей карбоновых кислот, третичных аминов и т. п.):

Последующим декарбоксилированием образующейся кислоты можно получить соответствующий алкен.
Синтез Кори-Винтера

Олефинирование Жюлиа-Лижо
Химические свойства
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
Особенностью алкенов являются также реакции циклоприсоединения и метатезиса.
Алкены легко вступают в реакции окисления, гидрируются с сильными восстановителями или водородом под действием катализаторов , а также способны к радикальному замещению.
Реакции электрофильного присоединения
В данных реакциях атакующей частицей является электрофил.
Галогенирование
Галогенирование алкенов, проходящее в отсутствие инициаторов радикальных реакций — типичная реакция электрофильного присоединения. Она проводится в среде неполярных инертных растворителей (например: CCl4):
Реакция галогенирования стереоспецифична —- присоединение происходит с противоположных сторон относительно плоскости молекулы алкена
Механизм реакций подобного типа в общем виде:

Гидрогалогенирование
Электрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова:


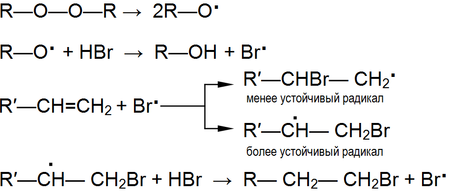
Однако в присутствии перекисей присоединение происходит преимущественно против этого правила (эффект Хараша):

Это объясняется тем, что реакция в данном случае будет протекать по радикальному механизму и присоединение радикала Br. идёт по стерически наиболее доступному концевому атому углерода двойной связи:

Гидроборирование
Присоединение гидридов бора к алкенам и последующее их расщепление в щелочной среде, открытое Г. Брауном в 1958 году, является столь важной реакцией, что за её обнаружение и изучение в 1979 году учёный был удостоен Нобелевской премии по химии
Присоединение происходит многоступенчато с образованием промежуточного циклического активированного комплекса, причём присоединение бора происходит против правила Марковникова — к наиболее гидрогенизированному атому углерода:
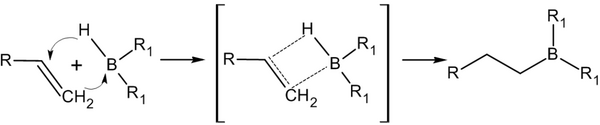
В синтезе используется, обычно, не собственно диборан, а его донорно-акцепторный комплекс с простым эфиром:

Алкилбораны легко расщепляются. Так под действием пероксида водорода в щелочной среде образуются спирты:
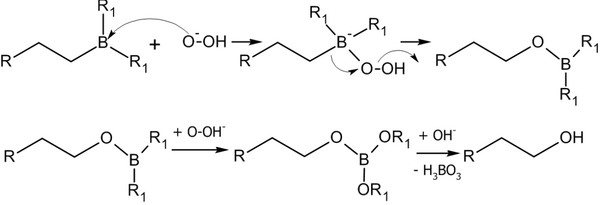
Реакция гидроборирования является реакцией син-присоединения — её результатом становятся цис-аддукты.
Гидратация
Реакция присоединения воды к алкенам протекает в присутствии серной кислоты
Реакция протекает по правилу Марковникова.
Алкилирование
Присоединение алканов к алкенам в присутствии кислотного катализатора (HF или H2SO4) при низких температурах приводит к образованию углеводорода с большей молекулярной массой и часто используется в промышленности
Данная реакция также может протекать по свободнорадикальному механизму в отсутствие катализатора при высокой температуре (500 °C) и давлении (15-30 МПа).
Прочие реакции электрофильного присоединения
Для алкенов также характерны следующие реакции электрофильного присоединения
- Присоединение спирта с образованием простого эфира:
- Получение спиртов по реакции оксимеркурирования-демеркурирования:
- Присоединение хлорноватистой кислоты с образованием хлоргидринов:
- Присоединение хлорангидридов с дальнейшим получением ненасыщенных кетонов (реакция Кондакова, катализатор ZnCl2[31]):
Реакции радикального присоединения
В условиях, способствующих гомолитическому разрыву связи, (высокая температура, облучение, наличие свободных радикалов и пр.) присоединение к алкенам происходит по радикальному механизму
и т. п.
Механизм реакции:
Реакции присоединения карбенов
Карбены CR2: — высокореакционные короткоживущие частицы, которые способны легко присоединяться к двойной связи алкенов. В результате реакции присоединения карбена образуются производные циклопропана:

Карбены в более характерном для них синглетном состоянии, вступая в реакцию, дают стереоспецифичные продукты син-присоединения.
Помимо собственно карбена, в подобные реакции могут вступать и его производные

Часто реакции присоединения карбенов происходят без прямых доказательств их свободного присутствия, то есть происходит перенос карбена. Для этого случая, а также если генерация свободного карбена ставится под сомнение, пользуются термином карбеноид.
В лабораторной практике часто пользуются реакцией Симмонса-Смита:

Подробнее о методах получения карбенов см. статью Карбены.
Гидрирование (реакция Сабатье-Сандеран)
Гидрирование алкенов непосредственно водородом происходит только в присутствии катализатора. Гетерогенными катализаторами гидрирования служат платина, палладий, никель
Гидрирование можно проводить и в жидкой фазе с гомогенными катализаторами (например: катализатор Уилкинсона ((C6H5)3P)3Rh Cl)
В качестве реагентов гидрирования могут выступать диимид (NH=NH), диборан (B2H6) и др
Реакции радикального замещения
При высоких температурах (более 400 °C) реакции радикального присоединения, носящие обратимый характер, подавляются. В этом случае становится возможным провести замещение атома водорода, находящегося в аллильном положении при сохранении двойной связи:
Реакция носит радикальный характер и протекает аналогично хлорированию алканов.
Аллильное бромирование обычно проводят N-бромсукцинимидом (реакция Воля-Циглера) в присутствии перекиси бензоила в среде тетрахлорметана или в бинарной смеси диметилсульфоксида и воды

Окисление
Окисление алкенов может происходить в зависимости от условий и видов окислительных реагентов как с разрывом двойной связи, так и с сохранением углеродного скелета.
Окисление неорганическими окислителями
- В мягких условиях возможно окисление посредством присоединения по двойной связи двух гидроксильных групп
На первом этапе происходит присоединение оксида осмия к алкену, затем под действием восстановителя (Zn или NaHSO3) образовавшийся комплекс переходит к диолу (Реакция Криге).
Аналогично реакция идёт в нейтральной или слабощелочной среде под действием KMnO4 (Реакция Вагнера)
- При действии на алкены сильных окислителей (KMnO4 или K2Cr2O7 в среде Н2SO4) при нагревании происходит разрыв двойной связи:
![{\mathsf {R\!\!-\!\!CH\!\!=\!\!C(R)(R')+[O]}}\rightarrow {\mathsf {R\!\!-\!\!COOH+R\!\!-\!\!C(O)\!\!-\!\!R'}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea6c33e33f2be61289db42c78b1747f6409c7d50)
- Некоторые окислители, например нитрат (III) таллия, окисляют алкены с перегруппировкой по следующей схеме
Окисление в присутствии солей палладия
В присутствии солей палладия этилен окисляется до ацетальдегида
Реакция идёт в кислой среде и является промышленным способом получения ацетальдегида.
Аналогично образуется ацетон из пропена.
Эпоксидирование
При действии на алкены пероксикарбоновых кислот образуются эпоксиды (реакция Прилежаева):

Реакция эпоксидирования используется для промышленного получения этиленоксида. Окислителем выступает кислород воздуха; процесс идёт на серебряном катализаторе при 200—250 °C под давлением.
Озонолиз
Озонолиз алкенов обычно проводят при низких температурах (от −80 до −30 °C) в инертном растворителе (гексан, тетрахлорметан, хлороформ, этилацетат и пр.). Непосредственные продукты озонолиза не выделяют, а подвергают дальнейшему гидролизу, окислению или восстановлению[38].
- Озонолиз в мягких условиях: алкен окисляется до альдегидов (в случае монозамещенных вицинальных углеродов), кетонов (в случае дизамещенных вицинальных углеродов) или смеси альдегида и кетона (в случае три-замещенного у двойной связи алкена).
На первой стадии происходит присоединение озона с образованием озонида. Далее под действием восстановителя (например: Zn + CH3COOH) озонид разлагается:
Если взять более сильный восстановитель, скажем — алюмогидрид лития, продуктом реакции будут спирты.
- Озонолиз в жёстких условиях — алкен окисляется до кислоты:
В данном случае разложение озонида происходит под действием окислителей (пероксид водорода, оксид серебра, пероксикислоты и пр.).
Реакция карбонилирования
Алкены в присутствии катализатора, высокой температуры и давления присоединяют CO и H2 с образованием альдегидов
Аналогично протекает реакция CO и H2O с образованием карбоновых кислот:
Если вместо воды использовать спирт, конечным продуктом реакции будет сложный эфир:
Реакции полимеризации
Полимеризация алкенов может протекать как по свободнорадикальному, так и катионно-анионному механизму.
По первому методу получают полиэтилен высокого давления:
Катализатором реакции выступают пероксиды.
Второй метод предполагает использование в качестве катализаторов кислот (катионная полимеризация), металлорганических соединений (катализаторы Циглера-Натта, анионная полимеризация). Преимуществом метода является возможность получения стереоселективных полимеров.








![{\mathsf {(C_{6}H_{5})_{3}P+CH_{3}Br}}\rightarrow {\mathsf {[(C_{6}H_{5})_{3}P\!\!-\!\!CH_{3}]Br}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/73a40add539caa3e89155b37347220e6410e653c)
![{\mathsf {[(C_{6}H_{5})_{3}P\!\!-\!\!CH_{3}]Br+C_{6}H_{5}Li}}\rightarrow {\mathsf {(C_{6}H_{5})_{3}P\!\!-\!\!CH_{2}\!\!:+}}{\mathsf {C_{6}H_{6}+LiBr}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce8a7eb853879473cc1c355a6a154aaf1711f5ad)



















![{\mathsf {R\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!R+[O]}}\rightarrow {\mathsf {2R\!\!-\!\!COOH}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5848e6203a9341c8ca9a8d6a7251d29c949dfdf5)
![{\mathsf {R\!\!-\!\!C(R)\!\!=\!\!CH\!\!-\!\!R+[O]}}\rightarrow {\mathsf {R\!\!-\!\!C(O)\!\!-\!\!CH(R)R}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea802883018bd47662e62ca08a22b0db107be036)






![{\mathsf {n\ CH_{2}\!\!=\!\!CH_{2}}}\rightarrow {\mathsf {-[-\!CH_{2}\!\!-\!\!CH_{2}\!-]_{n}-}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e97cdfc9a0a959098c6ee2d45a5bc394ba41aa9)