Алка́ны (также насыщенные углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
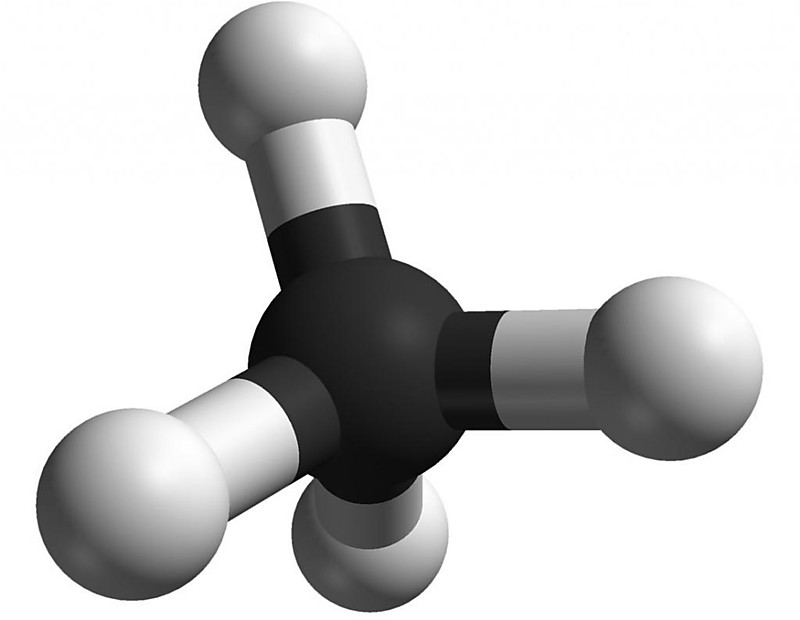
Все алканы относятся к более крупному классу алифатических углеводородов. Алканы являются насыщенными углеводородами, то есть содержат максимально возможное число атомов водорода для заданного числа атомов углерода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28'. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
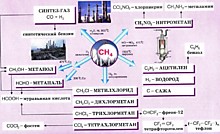
Простейшим представителем класса является метан (CH4). Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Бидд и М. К. Уайтинг.
Главным источником алканов (а также других углеводородов) являются нефть и природный газ, которые обычно встречаются совместно.
Восстановление галогенпроизводных алканов:
При каталитическом гидрировании в присутствии палладия галогеналканы превращаются в алканы[13]:
Восстановление иодалканов происходит при нагревании последних с иодоводородной кислотой:
Для восстановления галогеналканов пригодны также амальгама натрия, гидриды металлов, натрий в спирте, цинк в соляной кислоте или цинк в спирте[13]
Восстановление спиртов:
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода[14].
Восстановление карбонильных соединений
Реакция Кижнера — Вольфа:
Реакцию проводят в избытке гидразина в высококипящем растворителе в присутствии KOH[15].
Реакция Клемменсена[16]:
Гидрирование непредельных углеводородов
- Из алкенов
- Из алкинов
Катализатором реакции являются соединения никеля, платины или палладия[17].
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты — RCOO− перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путём сдваивания с подобным радикалом, и образуется R—R[18]. Например:
Газификация твёрдого топлива (Процессы Бертло, Шрёдера, Бергиуса)
Проходит при повышенной температуре и давлении. Катализатор — Ni (для Бертло), Mo (для Шрёдера) или без катализатора (для Бергиуса):
Реакция Вюрца
Реакция идёт в ТГФ при температуре −80 °C[19]. При взаимодействии R и R` возможно образование смеси продуктов (R—R, R`—R`, R—R`)
Синтез Фишера — Тропша
Реакция Дюма
Получением алканов с помощью декарбоксилирования солей карбоновых кислот, при сплавлении со щелочью (обычно NaOH или KOH):
Гидролиз карбида алюминия
Алканы имеют низкую химическую активность. Это объясняется тем, что одинарные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку связи С—C неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Галогенирование
1) Инициирование
2) Рост цепи
3) Обрыв цепи
Сульфирование
Сульфохлорирование (реакция Рида)

Нитрование
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных:
. При 350 гад по Ц идёт крегинг с образованием смеси продуктов.
Реакции окисления
Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов их разложения и взаимодействия с исходным алканом. Схема основной реакции автоокисления:
- Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается оксид углерода(II) или уголь (в зависимости от концентрации кислорода).
- Каталитическое окисление
В реакциях каталитического окисления алканов могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:



![\mathsf{CH_3CH_2CH_2CH_2OH \xrightarrow[]{LiAlH_4} CH_3CH_2CH_2CH_3 + H_2O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/710e85520863ccedbc9aec5cba5aef8754924ca6)














![{\displaystyle {\ce {\mathsf {Cl{\text{:}}Cl->[{h\nu }]Cl{\text{·}}+{\text{·}}Cl}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/541855de60e8ee945e8eeb2b311c20d1a4a56830)